विलयन की सांद्रता :-

विलयन मे विलेय कि वह मात्रा जो किसी एक निश्चित मात्रा या आयतन के विलयन या विलायक में घुली रहती है विलयन या विलायक में जितनी विलेय की मात्रा खुली रहती है उसे ही विलयन की सांद्रता कहते हैं अथवा किसी विलयन का संघटन उस विलयन की सांद्रता से व्यक्त कर सकते हैं | दुसरे शब्दो मे कह सकते है कि चाय को बनाते समय यदि पानी में चाय पत्ती और शक्कर को डाला जाता है यदि पानी में चाय पत्ती या शक्कर की मात्रा अधिक हो जाती है तो शक्कर या चाय पत्ती का स्वाद आता है जिससे चाय का विलयन सांद्र हो जाता है यदि विलयन में शक्कर या चाय पत्ती की मात्रा कम डालते हैं तो वह विलयन तनु हो जाता है विलयन की सांद्रता को हम दो रूप में व्यक्त कर सकते हैं
1. गुणात्मक रूप से :- गुणात्मक रूप से विलयन की सांद्रता को तनु एवं सांद्र के रूप में व्यक्त करते हैं जैसे
तनु विलयन :- वह विलयन जिसमें जिले की मात्रा कम डाली जाती है उसे तनु विलियन कहते हैं जैसे पानी में चाय पत्ती की कम मात्रा होने पर चाय का स्वाद फीकी या फिर स्वादहिन हो जाती है
सांद्र विलयन :- वह विलयन जिसमें विलेय की मात्रा को अधिक घोला जाता है तो उस विलयन को सांद्र विलयन कहा जाता है जैसे पानी में चाय पत्ती और शक्कर की अधिक मात्रा को डालने पर चाय का स्वाद कड़वा या अधिक मीठा हो जाता है
2. मात्रात्मक रूप से :-
इन इकाईयों के द्वारा विलयन की सांद्रता को हम निम्न रूप में व्यक्त करते हैं जैसे
द्रव्यमान प्रतिशत
आयतन प्रतिशत
द्रव्यमान आयतन प्रतिशत
पार्ट्स प्रति मिलियन
मोल अंश या मोल प्रभाज
मोलरता
मोललता
नॉर्मलता
फॉर्मलता
इन सभी के द्वारा विलयन की सांद्रता को हम मात्रात्मक रूप में व्यक्त करते हैं जैसे कि किसी विलयन या विलायक में कितनी प्रतिशत विलेय की मात्रा को घोला गया है जिसे हम उस विलयन में शुद्धता से जांच कर सकते हैं जैसे विलयन में विलायक का आयतन कितना है व कितना प्रतिशत विलेय मिलाया गया है अथवा इसकी मोलरता मोललता और मोल प्रभाज एवं आयतन प्रतिशत कितना है |
A. द्रव्यमान प्रतिशत :-
किसी 100 ग्राम विलयन में उपस्थित विलेय की ग्राम में मात्रा को द्रव्यमान प्रतिशत कहते हैं इसे( w/w %) या ( भार / भार प्रतिशत ) के द्वारा दर्शाते हैं।

सूत्र :-
जब प्रश्न में यदि हमें विलेय और विलायक का मान दिया हो तो इसे हम निम्न प्रकार से हल कर सकते हैं ।
जैसे, 100 ग्राम विलेय तथा 350 विलायक हो तो इसका द्रव्यमान प्रतिशत ज्ञात करें ?

हल :-
B. आयतन प्रतिशत :-

यदि किसी 100ml विलयन के आयतन में उपस्थित विलेय के आयतन (ml मे) की मात्रा को उस विलयन का आयतन प्रतिशत कहते हैं इसको हम v/v% से भी दर्शाते हैं । सूत्र :-
जैसे, हम कह सकते हैं कि एल्कोहल का जल में 10% विलयन से तात्पर्य है कि 10ml एल्कोहल को इतने पानी में मिलाते हैं जिससे विलयन का आयतन 100ml हो जाए । यदि परीक्षा में आयतन प्रतिशत ना पूछते हुए विलायक की मात्रा को पूछते हैं तो इसे भी इस सुत्र के द्वारा ज्ञात कर सकते हैं ।
C.द्रव्यमान-आयतन प्रतिशतता :-
माना किसी विलयन के 100ml गोल में उपस्थित विलय की मात्रा ग्राम में कोई इस विलयन की द्रव्यमान आयतन प्रतिशतता कहते हैं इसे हम w/v % से दर्शाते है ।
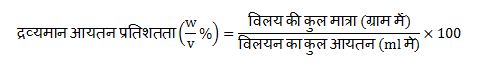
सूत्र :-
जैसे, इस सूत्र के द्वारा हम द्रव्यमान आयतन प्रतिशतता विलय की मात्रा तथा विलयन का आयतन आदि को आसानी से व्यक्त कर सकते हैं उदाहरण माना 5 % द्रव्यमान आयतन के शक्कर के 500 ml जलीय विलयन या गोल को बनाने में कितनी शक्कर की आवश्यकता पड़ेगी ।
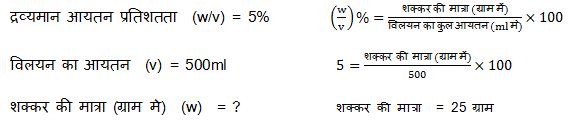
हल :- कभी-कभी परीक्षा में घनत्व दिया रहता है और द्रव्यमान प्रतिशत ज्ञात करने के लिए दिया जाता है तो इसे भी हम आसानी से निकाल सकते हैं
जैसे, माना की 22 ग्राम विलेय से 1000 ml विलयन बनाया जाता है और इस विलयन का घनत्व 2.2 gml-1 है तो इस विलयन की द्रव्यमान प्रतिशतता क्या होगी ।
हल :-

D.पार्ट्स प्रति मिलियन :-
इस इकाई का प्रयोग विलयनों में उपस्थित अत्यंत सूक्ष्म विलेय की मात्रा को व्यक्त करने में किया जाता है जो इस प्रकार के विलयनों की सांद्रता को दर्शाने में उपयुक्त होती है जिसे हम पार्ट्स प्रति मिलियन कहते है इसे हम निम्न प्रकार से व्यक्त कर सकते हैं जैसे किसी विलयन के 10 लाख वें भाग में विलेय के सभी भागों की संख्या तथा विलयन के सभी अवयवों के कुल भागों की संख्या के अनुपात में व्यक्त करते हैं।

सूत्र :-
इसको हम द्रव्यमान-द्रव्यमान, आयतन-आयतन तथा द्रव्यमान-आयतन में भी प्रदर्शित कर सकते हैं जैसे माना 1 लीटर समुद्री जल में उपस्थित ऑक्सीजन की मात्रा इतनी कम शाहदरा वाले बिलियन को समुद्री जल या टीपीएम द्वारा व्यक्त कर सकते हैं जब किसी जल वह वायुमंडल में प्रदूषण हो जाता है तो इसकी सांद्रता को हम से दर्शा सकते हैं
E.मोल अंश या मोल प्रभाज :-
इसे हम निम्न प्रकार से परिभाषित कर सकते हैं जैसे पदार्थ या अवयव के मोलों की संख्या तथा सभी पदार्थों या अवयवों के कुल मोलों की संख्या के अनुपात को ही हम उस मिश्रण का मोल अंश या मोल प्रभाज कहते हैं इसे सामान्यतः X के द्वारा प्रदर्शित किया जाता है

सूत्र :-
सामान्यतः मोल अंश का उपयोग हमेशा विलयनों के भौतिक गुणों के बीच संबंध में, गैसीय मिश्रण की गणना करने में एवं विलयन की सांद्रता का वाष्पदाब के साथ संबंध दर्शाने में किया जाता है ।
F.मोलरता :-

किसी भी एक लीटर विलयन में उपस्थित विलेय के मोलो की संख्या को हम उस विलयन की मोलरता कहते हैं इसे हम M के द्वारा प्रदर्शित करते हैं यह ताप पर निर्भर करता है क्योंकि तापमान बढ़ने पर आयतन मैं बदलाव होता रहता है इसलिए यह ताप पर निर्भर करती है सूत्र :-जैसे, NaOH के 0.25 mol को किसी 1 लीटर(1क्युविक डेसीमीटर) विलयन में घोला जाता है तो इसकी मोललता 0.25 m या 0.25 mol L-1 होती है
G.मोललता :-

किसी एक किलोग्राम विलायक में उपस्थित विलय या अवयवों के मोलो की संख्या को ही उस बिलियन की मोललता कहते हैं इसे हम m के द्वारा प्रदर्शित करते हैं इसे हम निम्न प्रकार से व्यक्त कर सकते हैं सूत्र :-जैसे , 1.00m या 1.00 mol kg-1 Kcl का जलीय विलयन अर्थात 1 mol Kcl को एक किलोग्राम पानी में घोलने पर उसकी मोललता 1m हो जाती है ।
H.नॉर्मलता :-
1 लीटर विलयन में विलेय पदार्थ की ग्राम में मात्रा के तुल्यांक को हम नॉर्मलता कहते हैं इसे N के द्वारा दर्शाया जाता है

सूत्र :-
I.फॉर्मलता :-
किसी एक लिटर विलयन में विलेय के ग्राम में सूत्र भारों की संख्या ही फॉर्मलता कहलाती है इससे F के द्वारा दर्शाया जाता है

सूत्र :-
सभी विलयनों की सांद्रता को व्यक्त करने वाली प्रत्येक विधियों में अपने-अपने गुण एवं दोष होते हैं । कुछ इकाइयां जैसे द्रव्यमान प्रतिशत, पार्ट्स प्रति मिलियन, मोल अंश एवं मोललता ये सभी विधियां ताप पर निर्भर नहीं करती जबकि मोलरता, आयतन प्रतिशत आदि विधियां ताप पर निर्भर करती है क्योंकि इन विधियों में आयतन होता है जो ताप पर निर्भर करता है जबकि द्रव्यमान पर निर्भर नहीं करता।
यह पोस्ट रसायन विज्ञान कक्षा बारहवीं के पाठ 2 के विलयन का दुसरा भाग है । पहला भाग इससे पहले हमारे द्वारा आपके लिए हमारी वेबसाइट पर डाल चुके हैं इस पोस्ट में हमने विलयन की सांद्रता को व्यक्त कैसे करते हैं तथा विलयन की सांद्रता को व्यक्त करने वाली कुछ विधियां जैसे द्रव्यमान प्रतिशतता, आयतन प्रतिशतता, मोलरता, मोलरता, एवं मूल अंश या मोल प्रभाज के बारे में लगभग पूरी जानकारी दी गई है जो परीक्षा की दृष्टि से महत्वपूर्ण है ।
दोस्तों यह पोस्ट आपको कैसा लगा यह बताने के लिए आप हमें कमेंट जरूर करें ताकि हम आपको इससे बेहतर जानकारी दे सकें यदि आपने हमारी वेबसाइट को सब्सक्राइब नहीं किया है तो इसे सब्सक्राइब करें ताकि हमारी पोस्ट आपके पास डायरेक्ट पहुंच सके और इसे अपने दोस्तों को भी शेयर करें । धन्यवाद

Leave a Reply