विद्युत रासायनिक सेल
ऐसे सेल जिसकी सहायता से हम रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित कर देते हैं तो ऐसे सेलों को विद्युत रासायनिक सेल कहते हैं इस सेल की खोज गैल्वेनी तथा वोल्टा नामक वैज्ञानिक ने की थी इसीलिए इसे सेल को गैल्वेनिक तथा वोल्टीय सेल कहते हैं ।
डेनियल सेल
डेनियल सेल का सन् 1836 में आविष्कार जॉन डेनियल ने किया जो एक ब्रिटिश केमिस्ट एंव मौसम विज्ञानी थे । डेनियल सेल विद्युत रासायनिक सेल है इस सेल के द्वारा रासायनिक ऊर्जा को विद्युत ऊर्जा में बदला जाता है इस विधि मैं हम दो पदार्थों का यूज करते हैं जिंक और कॉपर का ।
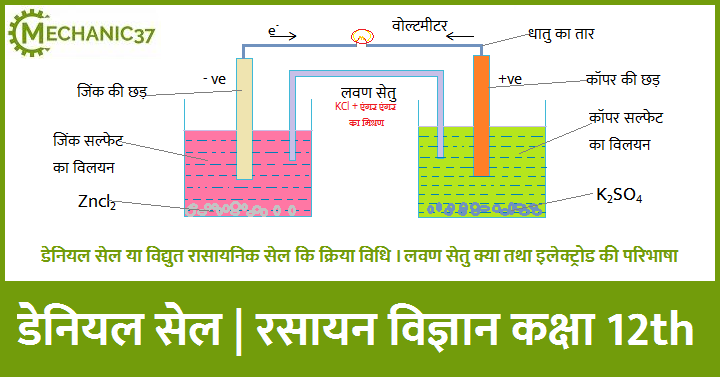
डेनियल सेल का निर्माण
डेनियल सेल के निर्माण के लिए हम सबसे पहले दो पात्र लेते हैं प्रथम पात्र में जिंक सल्फेट का विलयन भर लेते हैं तथा द्वितीय पात्र में कॉपर सल्फेट का विलयन भर लेते हैं अब हम जिंक सल्फेट वाले विलयन में जिंक की छड़ को डुबो लेते हैं जो एनोड के समान कार्य करती है जिस पर ऋण आवेश पाया जाता है और अब हम कॉपर सल्फेट वाले विलयन में कॉपर की छड़ को डुबो लेते हैं जो कि कैथोड के समान कार्य करती है जिस पर धन आवेश पाया जाता है अब हम इन दोनों के बीच मे एक धातु के तार की सहायता से पात्रो को जोड़ लेते हैं और बीच में वोल्ट्मीटर लगा लेते हैं अब इन दोनों पात्रों के मध्य में एक लवण सेतु भी लगा लेते हैं जो कांच का बना होता है तथा इस लवण सेतु में पोटेशियम क्लोराइड तथा एंगर एंगर नाम का मिश्रण भरा रहता है
इलेक्ट्रोड की परिभाषा
इलेक्ट्रोड की परिभाषा को हम निम्न प्रकार से समझेंगे जैसे किसी भी पदार्थ का हम जब इलेक्ट्रोड बनाते हैं तो उस पदार्थ का एक पात्र में विलयन लेते हैं तथा उसी पात्र में उस पदार्थ की छड़ को डुबो लेते हैं इस प्रकार से हम किसी पदार्थ का इलेक्ट्रोड बना सकते हैं । डेनियल सेल के निर्माण हमने कॉपर और जिंक का इलेक्ट्रोड बनाया है इसमें हमने दोनों के विलयन कॉपर सल्फेट तथा जिंक सल्फेट को अलग अलग पात्रों में लिया है
लवण सेतु
लवण सेतु देखने में उल्टे U आकार की नली होती है जिसके अंदर एंगर एंगर तथा पोटेशियम क्लोराइड का मिश्रण भरा रहता है एंगर एंगर एक प्रकार का अर्ध्द ठोस पदार्थ है जबकि पोटेशियम क्लोराइड एक प्रकार का लवण होता है
लवण सेतु की निम्न विशेषताएं
- लवण सेतु का प्रयोग दोनों पात्रों के मध्य आवेशों का संतुलन बनाए रखने मैं किया जाता है
- यदि डेनियल सेल में से लवण सेतु को हटा दिया जाए तो सेल कुछ समय बाद कार्य करना बंद कर देता है
डेनियल सेल में होने वाले महत्वपूर्ण परिवर्तन
- इसमें जिंक कि छड़ लगातार पतली होती रहती है
- इसमें कॉपर कि छड़ लगातार मोटी होती रहती है
- इसमें जिंक सल्फेट के विलयन की मात्रा लगातार बढ़ती जाती है
- इसमें कॉपर सल्फेट के विलयन की मात्रा लगातार घटती जाती है
- इसमें संपूर्ण क्रिया के दौरान ना तो उसमें ऊर्जा उत्सर्जित होती है और ना ही ऊर्जा अवशोषित होती है
रासायनिक अभिक्रियाएं
इस सेल के द्वारा जब ऊर्जा परिवर्तित होती तो इसमे कुछ महत्वपूर्ण अभिक्रियाएं होती हैं जो निम्न प्रकार हैं
एनोड पर अभिक्रियाएं
जब जिंक की छड़ को जिंक सल्फेट में डुबोई जाती है तो जिंक की छड़ मे ऑक्सीकरण विधि द्वारा जिंक आयन तथा इलेक्ट्रॉन मुक्त होते हैं जिंक आयन जिंक सल्फेट मे घुल जाते है जिससे जिंक आयन कि अधिकता हो जाती है ये जिंक आयन लवण सेतु मे उपस्थित पोटेशियम क्लोराइड से क्रिया कर ZnCl2 बनाता है जो ठोस होता है जिससे पात्र कि तली मे जम जाता है
Zn → Zn2+ + 2e–
2Zn + cl → Zncl2
कैथोड़ पर अभिक्रियाएं
जब कॉपर कि छड़ को कॉपर सल्फेट में डुबोई जाती है तो कॉपर की छड़ पर अपचयन कि क्रिया द्वारा कॉपर आयन तथा इलेक्ट्रॉन मुक्त होते हैं कॉपर आयन कॉपर कि छड़ पर जाके चिपक जाते है जिससे पात्र मे SO4 आयन कि अधिकता हो जाती है ये SO4 आयन लवण सेतु मे उपस्थित पोटेशियम क्लोराइड से क्रिया कर K2SO4 बनाता है जो ठोस होता है जिससे पात्र कि तली मे जम जाता है
Cu2+ + 2e– → Cu
2K + SO4 → K2SO4
रेडॉक्स अभिक्रिया
इस सल की अभिक्रिया में ही उत्सर्जित रासायनिक ऊर्जा को हम फिर किस ऊर्जा में परिवर्तित कर सकते हैं । रेडॉक्स अभिक्रिया के लिए हम जिंक को ठोस(s) रूप में तथा कॉपर आयन को लिक्विड (aq)मैं होता है जब इनकी अभिक्रिया होती है तो जिंक लिक्विड(aq) तथा कॉपर ठोस(s) में प्राप्त होता है ।
किसी अभिक्रिया में जिंक आयन तथा कॉपर आयन की सांद्रता जब एक इकाई या 1mol dm-3 होती हो तब इसका विद्युत विभाग 1.1 V होगा इसीलिए हम कह सकते हैं कि यह एक गैल्वैनी या वोल्टीय सेल है ।
Zn + Cu2+ → Zn2+ + Cu
यह पोस्ट कक्षा 12 वीं के रसायन विज्ञान के पाठ 3 के विद्युत रसायन से ली है यह वैधुतरसायन का दूसरा भाग है जिसमें हमने डेनियल एंव सेल विद्युत रासायनिक सेल, लवण सेतु तथा इलेक्ट्रोड के बारे में बताया है दोस्तों यदि आपको हमारी यह पोस्ट अच्छी लगे तो सब्सक्राइब करें एवं अपने दोस्तों को शेयर करें तथा हमें फीडबैक के लिए कमेंट जरूर करें । धन्यवाद।

Leave a Reply